Plan był prosty, przeanalizować patenty z zakresu aparatury USG (skrót od ultrasonography), które stanowią współczesna dziedzinę ULTRASONOGRAFII, ale wstępna analiza wyników badań patentowych uświadomiła mi, że liczba patentów z zakresu aparatury USG przekracza moje możliwości czasowe i intelektualne. Parafrazując cytat NIE POŻĄDAJ RZECZY NIEMOŻLIWYCH, Chilona ze Sparty, VI w. p.n.e , jedynym realnym rozwiązaniem, przedstawienia zastosowania USG, jest omówienie przykładowych patentów z tego zakresu, które mogą być użyteczne dla większości osobników płci męskiej. Ponieważ sam zaliczyłem problemy z gruczołem prostaty na warsztat trafiły patenty dotyczące badań USG gruczołu krokowego. W formie wstępu według Wikipedii USG, to zastosowanie ultradźwięków do badania i obrazowania tkanek w medycynie i weterynarii. https://pl.wikipedia.org/wiki/Ultrasonografia
Przechodząc do meritum zagadnienia należy stwierdzić, że olbrzymim problemem wśród męskiej części społeczeństwa jest współcześnie rak prostaty. Biorąc pod uwagę powszechność występowania rak stercza zajmuje drugie miejsce wśród chorób nowotworowych — częściej mężczyźni chorują jedynie na raka płuc. Choć poziom zachorowań wciąż jest wysoki, nowoczesna diagnostyka daje możliwość wykrycia nieprawidłowości we wczesnym stadium i wdrożenia skutecznej terapii. Rak prostaty to choroba, która rozwija się bardzo powoli i w początkowym stadium nie daje praktycznie żadnych zauważalnych objawów, a od rozwinięcia się komórek rakowych do wystąpienia pierwszych symptomów może minąć aż kilkanaście lat. Jego zdiagnozowanie jest wówczas możliwe tylko w toku systematycznych badań profilaktycznych. W bardziej zaawansowanym stadium Pacjent boryka się z wieloma krępującymi i uciążliwymi objawami. Przede wszystkim są to problemy związane z funkcjonowaniem układu moczowego, jak np. trudności z oddawaniem moczu, ból i uczucie pieczenia w obrębie cewki moczowej czy nieustające uczucie parcia na pęcherz. Tego rodzaju symptomy wynikają z budowy męskiego układu moczowo-płciowego i tym, że cewka moczowa sąsiaduje z gruczołem krokowym.
W celu przeciwdziałania ryzyku zachorowania na nowotwór prostaty, należy zwrócić uwagę na konieczność badań profilaktycznych, takich jak podstawowe badanie PSA, które jest wykonywane na podstawie próbki krwi. Oprócz tego nie należy zapominać o regularnych wizytach u lekarza urologa. Okazuje się, że rak prostaty ma doskonałe rokowania, pod warunkiem, że zostanie zdiagnozowany na wczesnym stadium rozwoju choroby. Mężczyźni, u których zaobserwowany zostaje podwyższony poziom PSA i podejrzewa się obecność raka gruczołu krokowego, najczęściej zostają kierowani do zabiegu, jakim jest biopsja prostaty.
Biopsja prostaty to podstawowe badanie przeprowadzane w związku z diagnostyką raka prostaty. Wykonywane jest najczęściej przy znieczuleniu miejscowym. W trakcie procedury przez odbytnicę zostaje wprowadzona sonda USG oraz specjalna igła biopsyjna, za pomocą której pobierane zostają drobne fragmenty tkanki gruczołu krokowego, jest to możliwe właśnie dzięki podglądowi USG. Następnie pobrany materiał zostaje poddany analizie histopatologicznej, która ocenia możliwe zmiany nowotworowe. Niestety jest to badanie inwazyjne, przede wszystkim jest to dość bolesna, nieprzyjemna procedura. Po drugie, badanie to nie jest dokładne, bardzo często zdarza się, że wyniki są błędnie ujemne. Szybki postęp w dziedzinie urologii zaowocował ulepszoną metoda diagnostyczna gruczołu krokowego, która polega na biopsji gruczołu prostaty poprzez odbyt, pod kontrolą obrazu TRUS i rezonansu magnetycznego, przeprowadzaną przez urologa lub urologa wraz z radiologiem w asyście pielęgniarki. Biopsja fuzyjna, bo taką przyjęła nazwę, oparta jest na fuzji obrazów wieloparametrycznego rezonansu magnetycznego MRI i USG w czasie rzeczywistym. Warto dodać, że od roku 2015 Europejskie Towarzystwo Urologiczne (EAU) rekomenduje, aby każda powtórna biopsja prostaty przeprowadzana była w oparciu o badanie MRI i stwierdzone w nim ewentualne nieprawidłowości. Od 2019 roku zgodnie z wytycznymi badanie rezonansem magnetycznym zalecane jest także przed pierwszą biopsją. Podczas zabiegu pobieranych jest od kilku do kilkudziesięciu próbek w zależności od tego, ile zostało dotychczas wykonanych biopsji oraz ile podejrzanych ognisk jest widocznych we wcześniej wykonanym rezonansie prostaty.
Pierwszy patent z tego zakresu US9375195 System and method for real-time ultrasound guided prostate needle biopsy based on biomechanical model of the prostate from magnetic resonance imaging data, Siemens Medical Solution, Kamen at al., Data patentu 28.06.2016., dotyczy biopsji igłowej TRUS (ultrasonografia przezodbytnicza transrectal ultrasound ), a w szczególności biopsji fuzyjnej pod kontrolą ultradźwięków w oparciu o biomechaniczny model gruczołu krokowego otrzymany z danych obrazowania rezonansu magnetycznego. Rak prostaty jest zwykle diagnozowany za pomocą biopsji transrektalnej (przezodbytniczej) ultrasonografii (US), którą zazwyczaj przepisuje się w wyniku podwyższonego poziomu swoistego antygenu sterczowego (PSA) lub w wyniku wykrycia namacalnego guzka podczas cyfrowego badania doodbytniczego (DRE). Wprowadzenie biopsji pod kontrolą obrazu przy użyciu US znacznie zwiększyło dokładność biopsji, w porównaniu z bardzo słabą dokładnością wykonywania biopsji tzw. ślepej, co spowodowało, że transrektalne badanie z udziałem USG stało się powszechnie akceptowaną metodologią biopsji prostaty.

Obrazowanie metodą rezonansu magnetycznego (MR) może wyraźnie przedstawiać nie tylko gruczoł krokowy, ale także jego podstrukturę, w tym strefę środkową, przejściową i obwodową. Obrazy MR ważone T2 mogą uwidocznić guzki w strefie obwodowej prostaty. Lokalizacja ognisk guza i strefy obwodowej za pomocą obrazowania MR przed biopsją gruczołu krokowego może zwiększyć ogólny wskaźnik wykrycia raka. Lokalizacja ognisk guza i strefy obwodowej za pomocą obrazowania MR przed biopsją gruczołu krokowego może zwiększyć ogólny wskaźnik wykrycia raka. Lokalizując podejrzane zmiany nowotworowe lub cele na obrazie MR i korelując wizualnie lokalizacje z obrazami podczas biopsji pod kontrolą USG, dokładność biopsji pod kontrolą USG, wspomagana obrazowaniem MR, wynosiła 67% w badaniu 33 pacjentów. Dane do tego badania zostały poddane żmudnej kontroli wzrokowej, której nie można wdrożyć jako rutynowej praktyki klinicznej.
W przykładzie wykonania niniejszego wynalazku prostata jest segmentowana w trójwymiarowym obrazie ultradźwiękowym pacjenta. Odniesiony do pacjenta model biomechaniczny gruczołu krokowego wyodrębniony z obrazu 3D pacjenta jest połączony z granicą segmentowanej gruczołu krokowego w trójwymiarowym obrazie USG, co skutkuje połączonym modelem biomechanicznym prostaty 3D. W odpowiedzi na ruch sondy ultradźwiękowej do nowej lokalizacji, odbierany jest bieżący obraz ultrasonograficzny 2D uzyskany przez sondę ultradźwiękową w nowym miejscu. Skondensowany biomechaniczny model 3D prostaty ulega deformacji na podstawie bieżącego obrazu ultrasonograficznego 2D, aby dopasować się do aktualnego odkształcenia gruczołu krokowego z powodu ruchu sondy ultradźwiękowej do nowej lokalizacji.
FIG.1 ilustruje system do implementacji biopsji stercza igłą próbkującą w czasie rzeczywistym według przykładu wykonania wynalazku; FIG.2 ilustruje ruch sondy ultradźwiękowej w celu uzyskania płynnego badania prostaty 3D i wyrównania igły w pozycje docelową w prostacie; FIG.3 ilustruje sposób biopsji igłowej sterowanej na podstawie USG, według przykładu wynalazku; FIG.4 ilustruje segmentację prostaty w przykładowym obrazie rezonansu magnetycznego; FIG.5 ilustruje przykładową segmentację prostaty w trójwymiarowym obrazie USG; FIG.6 ilustruje sposób odkształcania stopionego biomechaniki 3D prostaty w celu dopasowania do aktualnego odkształcenia prostaty według przykładu wykonania niniejszego wynalazku; FIG.7 ilustruje przykładowe kontury prostaty wyodrębnione z obrazu 2D i zrekonstruowane na podstawie modelu prostaty 3D; FIG.8 ilustruje przykładowe odkształcenie topionego biomechanicznego modelu 3D prostaty w celu dopasowania do obecnej granicy prostaty; FIG.9 przedstawia schemat blokowy komputera zdolnego do realizacji niniejszego wynalazku.
FIG.1 ilustruje system do implementacji biopsji prostaty prowadzonej w czasie rzeczywistym według przykładu wykonania niniejszego wynalazku. System zawiera zewnętrzny system śledzenia 105, który śledzi sondę ultradźwiękową 110 w stacjonarnym układzie współrzędnych, w tak zwanym stałym układzie współrzędnych. Położenie sondy 110, która może być ultradźwiękowym przetwornikiem, jest kontrolowane przez czujnika śledzenia 115 umieszczony na sondzie 110. Czujnik 115 może być magnetycznym czujnikiem położenia, co nie ogranicza zastosowania innego typu czujnika położenia sondy. Igła 120, która jest używana do celów biopsji, jest przymocowana do sondy 110. System zawiera ponadto komputer przedstawiony na Fig.6, który może wyświetlać obraz referencyjny 130 prostaty 135a, który przedstawia rakowy element 140 stercza. Obraz referencyjny 130 może być obrazem MR lub obrazem tomografii komputerowej (CT). FIG. 2 ilustruje ruch sondy US w ramach swobodnego przeglądania prostaty 3D i wyrównania igły do pozycji docelowej w prostacie. Obraz (a) z FIG. 2 ilustruje sposób wizualizacji 3D prostaty 200 przy użyciu sondy US 202. Jak pokazano na rysunku (a) na FIG. 2, sonda 202 jest przemieszczana do różnych pozycji względem prostaty 200 i obraz 2D US jest uzyskiwany wzdłuż płaszczyzny obrazowania 2D 204a-204f sondy US 202 w każdej pozycji. Obrazy 2D uzyskane w trakcie cyklu 3D prostaty 200 można następnie zrekonstruować do obrazu 3D US z wykorzystaniem informacji śledzenia sondy US 202 wraz z informacjami kalibracyjnymi sondy US 202. Obrazy (b) i (c) z FIG. 2 przedstawiają ruch sondy US 202 w celu wyrównania trajektorii 206a i 206b prowadnicy igły przymocowanej do sondy US, z pozycją zmiany rakowej 208a i 208b, która jest nałożona na podstawie informacji z obrazu MR. Jak pokazano na zdjęciach (b), sonda 202 musi zostać przesunięta, aby wyrównać trajektorię igły 206a z pozycją zmiany patologicznej 208a, a ruch ten powoduje deformację anatomii prostaty 200 w porównaniu z prostatą podczas płynnego przeglądania na podstawie obrazu 3D MR. Ta deformacja sprawia, że informacje anatomiczne oparte na MR, które zostały dopasowane do prostaty w trójwymiarowym obrazie US wygenerowanym podczas ręcznego ruchu sondy, są nieaktualne. Jak pokazano na rysunku (c), sonda 202 musi zostać ponownie przesunięta, aby wyrównać trajektorię igły 206b z inną pozycją uszkodzenia 208b, co powoduje kolejną deformację prostaty 200 przez sondę 202. FIG.3 ilustruje sposób kierowanej przez USA biopsji igły prostaty według przykładu wykonania wynalazku. Sposób z FIG.3 łączy specyficzny dla pacjenta model gruczołu krokowego wygenerowany z danych obrazu planowania 3D, takich jak dane MR, z obrazami ultrasonograficznymi w czasie rzeczywistym w celu namierzenia podejrzanych obszarów gruczołu krokowego i dostosowuje połączony model prostaty w celu odzwierciedlenia deformacji gruczołu krokowego co zapewnia uaktualnienie położenia sondy ultradźwiękowej opartego na danych śledzenia sondy ultradźwiękowej i biomechanicznych właściwościach prostaty.
Odnosząc się do FIG.3, w etapie 302, generowany jest referencyjny, specyficzny dla pacjenta model anatomiczny gruczołu krokowego z danych widoku obrazu 3D pacjenta. W możliwej implementacji, etap 302 może wystąpić w fazie planowania przed procedurą biopsji. W szczególności, w fazie planowania poprzedzającej procedurę biopsji, dane obrazu pacjenta 3D są uzyskiwane za pomocą urządzenia do akwizycji obrazu. W korzystnym przykładzie wykonania dane obrazu prostaty mogą być danymi obrazu 3D MR pacjenta uzyskanego przy użyciu skanera MR, chociaż niniejszy wynalazek nie jest jedynie ograniczony do tego typu zobrazowania, ponieważ inne sposoby obrazowania, takie jak CT, mogą być również wykorzystane do wygenerowania zobrazowania prostaty. Gruczoł krokowy może być segmentowany według danych obrazu 3D ręcznie lub przy użyciu półautomatycznej albo w pełni automatycznej techniki segmentacji prostaty. Wracając do FIG.3, w etapie 304 określa się właściwości biomechaniczne prostaty. W korzystnym wykonaniu właściwości biomechaniczne obejmują wartości modułu Younga i współczynnik Poissona dla prostaty. Jak dobrze wiadomo, moduł Younga dla prostaty jest miarą sztywności tkanki prostaty, a współczynnik Poissona dla prostaty jest ujemnym współczynnikiem poprzecznego odkształcenia w stosunku do położenia osiowego tkanki prostaty. W jednej możliwej implementacji, nominalne wartości właściwości biomechanicznych przedstawione w literaturze mogą być wykorzystane do biomechanicznych właściwości prostaty pacjenta. W innej możliwej implementacji można uzyskać spersonalizowane wartości biomechanicznych właściwości prostaty pacjenta na podstawie skanów elastografii pacjenta. W możliwym przykładzie wykonania, etap 304 może być również wykonywany w fazie planowania przed procedurą biopsji. W etapie 306, na początku sesji fuzyjnej biopsji uzyskuje się trójwymiarowy obraz śledzonych obrazów USG za pomocą sondy ultradźwiękowej z systemem śledzenia sondy ultradźwiękowej. Obraz 3D ultradźwięków jest generowany podczas wobulacji 3D. W szczególności sonda ultradźwiękowa śledzi system śledzenia, a obraz ultradźwiękowy 3D jest rekonstruowany na podstawie obrazów ultrasonograficznych 2D uzyskanych podczas przemiatania w oparciu o informacje o śledzeniu sondy ultradźwiękowej wraz z informacjami o kalibracji sondy ultradźwiękowej. System śledzenia może wykorzystywać magnetyczny czujnik śledzenia do śledzenia sondy ultradźwiękowej, jak pokazano na FIG.1 Alternatywnie możliwe jest również, że śledzenie mechaniczne lub optyczne może być stosowane zamiast śledzenia magnetycznego w celu śledzenia położenia i orientacji sondy ultradźwiękowej. W etapie 308 wykrywana jest aktualna granica 3D prostaty przez automatyczne segmentowanie prostaty na obrazie ultrasonograficznym 3D. Segmentacja prostaty na obrazie ultrasonograficznym 3D daje aktualny stan deformacji gruczołu krokowego. W możliwej implementacji, prostata może zostać podzielona na obraz 3D ultradźwięków za pomocą wykresu segmentacji opartego na ziarnach rakowych pierwszego planu i tła, automatycznie określonych na podstawie specyficznego dla pacjenta modelu anatomicznego gruczołu krokowego wygenerowanego z danych obrazu planowania 3D. Wracając do FIG.3, w etapie 310, referencyjny specyficzny dla pacjenta model biomechaniczny jest połączony z obecną granicą 3D prostaty w celu zamapowania referencyjnego specyficznego dla pacjenta modelu biomechanicznego do aktualnego stanu deformacji gruczołu krokowego, co zapewnia zespolony model biomechaniczny stercza 3D. Natychmiast po wykonaniu etapu 308, obecna granica 3D prostaty odpowiada segmentacji gruczołu krokowego w obrazie ultrasonograficznym 3D. Odpowiednio, referencyjny, specyficzny dla pacjenta model biomechaniczny stercza z danych obrazu MR jest połączony z segmentowanym modelem 3D prostaty z obrazu ultradźwiękowego 3D. Gdy procedura powraca do etapu 310 po etapie 316, bieżąca granica 3D prostaty otrzymana metoda USG jest wynikiem deformacji poprzednio połączonego biomechanicznego model prostaty 3D w etapie 316. W etapie 312 lokalizacje podejrzanych regionów z połączonego biomechanicznego modelu prostaty 3D są mapowane na bieżący obraz 2D w US i wyświetlane, na przykład za pomocą urządzenia wyświetlającego systemu komputerowego. Podczas procedury biopsji obrazy US 2D są pobierane przez sondę US w czasie rzeczywistym, a lokalizacje podejrzanych regionów są mapowane na obrazy 2D w US, aby pokazać docelowe miejsca biopsji. Wyświetlanie obrazów 2D w US, łącznie z lokalizacjami docelowymi, może być wykorzystane do prowadzenia lekarza prowadzącego procedurę biopsji. Na przykład, lokalizacje podejrzanych regionów (np. zmiany chorobowe lub guzy) mogą być wyświetlane jako krzyżyki nałożone na bieżący obraz ultrasonograficzny 2D lub jako kontury nałożone na bieżący obraz ultrasonograficzny 2D pokazujący granice podejrzanych regionów przy użyciu różnych stylów linii lub kolorów . W etapie 314 sonda US jest przenoszona do nowej lokalizacji i odbierany jest obraz ultradźwiękowy 2D uzyskany w nowej lokalizacji. Aby wykonać procedurę biopsji, lekarz przesuwa sondę ultradźwiękową, aby wyrównać igłę przymocowaną do sondy z docelowym miejscem w prostacie. System śledzenia śledzi pozycję i orientację sondy US. Obrazy USG są pobierane przez sondę US w czasie rzeczywistym podczas procedury biopsji. Po przeniesieniu sondy US do nowej pozycji otrzymywany jest obraz ultradźwiękowy 2D uzyskany przez sondę w nowej pozycji. Jak opisano powyżej i zilustrowano na obrazach (a) i (b) z FIG.2, ruch sondy ultradźwiękowej powoduje deformację prostaty.
W etapie 316 skondensowany biomechaniczny model prostaty 3D prostaty ulega deformacji na podstawie konturu prostaty w bieżącym obrazie 2D w US, pozycji 3D i orientacji sondy US oraz właściwości biomechanicznych w celu zapewnienia aktualnej granicy 3D prostaty, który odpowiada aktualnemu stanowi deformacji prostaty. W miarę przesuwania sondy ultradźwiękowej wykorzystuje się różne informacje do oszacowania deformacji gruczołu krokowego wynikającej z ruchu sondy ultradźwiękowej. Połączony biomechaniczny model prostaty 3D zawiera informacje anatomiczne z danych obrazu 3D i biomechanicznych właściwości prostaty. Oprócz specyficznego dla pacjenta modelu anatomicznego gruczołu krokowego i modelu wgłębienia , w danych obrazowych widoku 3D można również wykryć anatomię otaczającą strukturę gruczołu krokowego i dołączyć do połączonego modelu biomechanicznego prostaty 3D. Bardziej szczegółowe określenie struktur otaczających prostatę i podział na podstruktury, takie jak pęcherz moczowy, odbyt i mięśnie, mogą zwiększyć zdolność modelowania, a tym samym poprawić dokładność szacowanej deformacji. FIG.4 ilustruje segmentację prostaty na przykładowym obrazie MR. Jak pokazano na FIG. 4, granica prostaty 400 jest segmentowana na obrazie MR. Oprócz segmentacji gruczołu krokowego, podejrzane regiony gruczołu krokowego są również identyfikowane w danych obrazu planowania 3D, a lokalizacje podejrzanych regionów są zawarte w odnośniku. Podejrzane regiony mogą być zidentyfikowane ręcznie przez lekarza lub automatycznie przy użyciu technik wykrywania opartych na obrazach. Na przykład guzki w strefie obwodowej gruczołu krokowego można uwidocznić za pomocą obrazów MR ważonych T2. Lokalizacje ognisk guza i strefy obwodowej w danych obrazu MR można zidentyfikować i uwzględnić w referencyjnym modelu anatomicznym prostaty specyficznym dla pacjenta. Ponadto informacje funkcjonalne można uzyskać za pomocą technik takich jak obrazowanie ważone dyfuzyjnie (DWI), dynamiczne obrazowanie kontrastowe (DCE), obrazowanie z przesunięciem chemicznym (CSI) i spektroskopia MRI w celu dalszego scharakteryzowania tkanki guza prostaty. FIG.6 ilustruje sposób deformacji połączonego modelu biomechaniki 3D prostaty w celu dopasowania do aktualnego odkształcenia prostaty według przykładu wykonania niniejszego wynalazku. Sposób z FIG.6 można wykorzystać do realizacji kroku 316 z FIG. 3. Sposób z FIG.6 prowadzi do zdeformowanego modelu biomechanicznego prostaty 3D, który uwzględnia aktualna granicę 3D prostaty. Opisane powyżej metody biopsji igłowej sterowanej ultradźwiękami w oparciu o biomechaniczny model gruczołu krokowego z danych obrazu planowania 3D mogą być realizowane na komputerze przy użyciu znanych procesorów komputerowych, jednostek pamięci, urządzeń pamięci masowej, oprogramowania komputerowego i innych komponentów . Schemat blokowy takiego komputera jest przedstawiony na FIG. 9. Komputer 902 zawiera procesor 904, który kontroluje ogólne działanie komputera 902, wykonując instrukcje programu komputerowego, które definiują taką operację. Instrukcje programu komputerowego mogą być przechowywane w urządzeniu pamięciowym 912 (np. dysku magnetycznym) i ładowane do pamięci 910, gdy pożądane jest wykonanie instrukcji programu komputerowego. Zatem etapy sposobów z FIG. 3 i 6 mogą być określone przez instrukcje programu komputerowego przechowywane w pamięci 910 i / lub pamięci 912 i sterowane przez procesor 904 wykonujący instrukcje programu komputerowego. Urządzenie 920 do pozyskiwania obrazów, takie jak urządzenie skanujące MR, może być podłączone do komputera 902 w celu wprowadzania danych obrazu do komputera 902.
Z kolei Aplikacja patentowa US2011178389A1 Fused image moldalities guidance, EIGEN Inc., Kumar et al., Data zgłoszenia 21.07.2011 dotyczy dziedziny obrazowania medycznego, a w szczególności rejestracji wielu obrazów medycznych, aby umożliwić lepsze prowadzenie procedur medycznych. W jednym z zastosowań wielokrotne obrazy medyczne są rejestrowane w obrazie multimodalnym, aby pomóc urologom i innemu personelowi medycznemu w znalezieniu optymalnych miejsc docelowych do biopsji i / lub terapii. Obrazowanie medyczne, w tym promieniowanie rentgenowskie, rezonans magnetyczny (MR), tomografia komputerowa (CT), ultradźwięki i różne kombinacje tych technik są wykorzystywane do zapewnienia obrazów wewnętrznej struktury pacjenta do celów diagnostycznych, jak również doprocedur interwencyjnych. Jednym z zastosowań zobrazowania medycznego 3D do wykrywanie i / lub leczenie raka prostaty.

Tradycyjnie jako standard do wykrywania raka prostaty powszechnie stosuje się podwyższony poziom antygenu prostaty (PSA). Aby lekarz zdiagnozował raka prostaty, należy wykonać biopsję gruczołu krokowego. Biopsja gruczołu krokowego wymaga uzyskania wielu próbek tkanek z różnych obszarów prostaty. Na przykład, prostata może być podzielona na sześć regionów (tzw. biopsja sekstantu), wierzchołek, środek i podstawa obustronnie, przy czym jedna reprezentatywna próbka jest losowo uzyskiwana z każdego sekstantu. Takie losowe pobieranie próbek jest nadal najczęściej stosowaną metodą, chociaż w ostatnich latach spotkało się z krytyką w zakresie niezdolności do próbkowania regionów, w których mogą występować znaczne ilości tkanek złośliwych, co skutkuje wysokimi fałszywymi ujemnymi wskaźnikami wykrywania. Chociaż TRUS (ultrasonografia przez odbytnicza – transrectal ultrasound ) zapewnia wygodną platformę do prowadzenia w czasie rzeczywistym biopsji lub terapii, uważa się, że niektóre tkanki złośliwe mogą być izoechogeniczne w TRUS. Oznacza to, że różnice między komórkami złośliwymi a otaczającą zdrową tkanką mogą nie być dostrzegalne na obrazie USG. W związku z tym stosowanie TRUS jako jedynego sposobu prowadzenia może nie pozwolić na wizualną identyfikację potencjalnie złośliwej tkanki. Co więcej, plamki i cienie utrudniają interpretację obrazów ultradźwiękowych, a wiele nowotworów jest często niewykrytych nawet po kilku biopsjach, które charakteryzują się wieloma próbkami (> 20) . Z powodu trudności ze znalezieniem nowotworu, operatorzy często uciekali się do prostego zwiększania liczby rdzeni biopsji (np. biopsji saturacyjnej), co do których wykazano, że nie zapewnia znaczącej poprawy wskaźnika wykrywalności, lecz zamiast tego zwiększa zachorowalność. W celu złagodzenia tej trudności zaproponowano atlas nowotworowy, który dostarczył statystyczny obraz prawdopodobieństwa nałożony na obraz TRUS pacjenta, aby pomóc w wyborze miejsc, w których wykazano, że zawierają tkankę raka, np. strefa obwodowa stanowi około 80% raka prostaty. Aby poprawić identyfikację regionów potencjalnie nowotworowych do procedur biopsji lub terapii, zaproponowano wykorzystanie różnych sposobów obrazowania, które mogą zapewnić lepszy kontrast tkanki. Takie różne sposoby obrazowania mogą umożliwiać lokalizowanie podejrzanych regionów lub uszkodzeń w obrębie gruczołu krokowego, nawet gdy takie regiony / zmiany są izoechogeniczny. Oznacza to, że metody obrazowania, takie jak tomografia komputerowa (CT) i rezonans magnetyczny (MRI), mogą dostarczyć informacji, których nie można uzyskać wyłącznie z obrazowania TRUS. Podczas gdy CT nie ma dobrego kontrastu tkanek miękkich, aby pomóc w wykrywaniu nieprawidłowości w obrębie gruczołu krokowego, może być pomocny w znajdowaniu rozszerzeń zewnątrzkomórkowych, gdy tkanka miękka rozciąga się na około prostaty i sąsiednie struktury oraz inwazje pęcherzyków nasiennych.
Uważa się, że rezonans magnetyczny zapewnia najlepszy kontrast tkanek miękkich we wszystkich metodach obrazowania. Zarówno anatomiczny (np.T1, T2), jak i funkcjonalny MRI, np. dynamiczne wzmocnienie kontrastowe (DCE), obrazowanie spektroskopowe rezonansu magnetycznego (MRI) i obrazowanie z ważeniem dyfuzyjnym (DWI) mogą pomóc w wizualizacji i ilościowym określeniu regionów gruczołu krokowego w oparciu o określone cechy. Struktury strefowe w obrębie gruczołu nie mogą być wyraźnie widoczne na obrazach T1. Jednak po biopsji może pojawić się krwotok o wysokiej intensywności sygnału w celu odróżnienia tkanki normalnej od patologicznej. W obrazach T2 granice stref można łatwo zaobserwować. Strefa peryferyjna wydaje się być bardziej intensywna w stosunku do strefy środkowej i przejściowej. Nowotwory w strefie obwodowej charakteryzują się niższą intensywnością sygnału w porównaniu z sąsiednimi regionami. Odpowiednio, jednym rozwiązaniem jest zarejestrowanie wcześniej uzyskanego obrazu (np.obrazu MRI lub CT), z obrazem 3D TRUS uzyskanym podczas procedury. Obszary zainteresowania, które można zidentyfikować we wstępnie uzyskanej objętości obrazu, można powiązać z odpowiednimi lokalizacjami w obrazie TRUS, tak aby mogły być wizualizowane podczas / przed planowaniem biopsji lub zastosowaniem terapeutycznym. Na tym tle opracowano niniejszy wynalazek., gdzie FIG.1 ilustruje system obrazowania przez-odbytniczego USG (TRUS), które można wykorzystać do uzyskania wielu dwuwymiarowych obrazów ultrasonograficznych prostaty 12, gdzie sondę TRUS 10 można wstawić doodbytniczo, aby skanować obszar gruczołu krokowego. Odpowiednio, sonda 10 wyposażona w ruchoma głowice USG, sterowaną silnikiem, która może rejestrować wiele pojedynczych obrazów 2D podczas jej obracania w sąsiedztwie badanego gruczołu. FIG.2AC. Każdy z tych pojedynczych obrazów może być reprezentowany jako obraz dwuwymiarowy. W każdym przypadku dwuwymiarowe obrazy mogą być łączone w celu wygenerowania trójwymiarowego obrazu FIG.2C. System komputerowy 30 uruchamia oprogramowanie aplikacyjne, które może kontrolować komponenty systemu TRUS, zapewniać interfejs użytkownika i kontrolować różne funkcje systemu obrazowania, gdzie monitor 40 służy do wyświetlania rekonstrukcji obrazu prostaty 250. System komputerowy może również wykonywać omawianą funkcjonalność multimodalnego łączenia obrazów. W celu wygenerowania dokładnego modelu powierzchniowego prostaty z obrazów ultradźwiękowych 2D, obrazy ultradźwiękowe wymagają segmentacji. Segmentacja odnosi się do procesu dzielenia obrazu cyfrowego na wiele segmentów (zestawy pikseli) w celu wyizolowania interesującego obiektu. Ponieważ obrazy ultradźwiękowe często nie zawierają ostrych granic między interesującą strukturą gruczołu a tłem obrazu, (np. FIG.3 w lewym dolnym panelu, gdzie prostata 250 na obrazie USG 204 nie ma wyraźnych granic, to pożądane jest podzielenie obrazów na triangulowany model powierzchniowy. Segmentacja może być wykonana ręcznie lub w zautomatyzowanej procedurze, której sposób segmentacji prostaty jest przedstawiony w patencie U.S.7,804,989.
Po określeniu granic można uzyskać informację wolumetryczną i / lub utworzyć szczegółowy model powierzchni siatki 3D 254. Patrz na przykład prawy dolny panel 208 ekranu z FIG.3, według którego model powierzchni 3D można wykorzystać na przykład do prowadzenia biopsji lub terapii. Ponadto, system i sposób segmentacji mogą być realizowane w systemach ultradźwiękowych tak, że szczegółowy model powierzchni może być generowany, podczas gdy sonda TRUS pozostaje w pobliżu prostaty, co oznacza, że model powierzchniowy może być utworzony zasadniczo w czasie rzeczywistym. Sonda 10 zawiera pistolet do biopsji wyposażony w igłę napędzaną sprężyną, która jest obsługiwana w celu uzyskania próbki z pożądanego obszaru w obrębie prostaty. Chociaż TRUS jest stosunkowo łatwą i tanią metodą generowania obrazów w czasie rzeczywistym to istnieje kilka niedociągnięć podczas i identyfikacji struktur będących przedmiotem zainteresowania. Na przykład niektóre złośliwe komórki i / lub raki mogą być izoechogeniczne, co oznacza to, że różnica iędzy złośliwymi komórkami a zdrową otaczającą tkanką może nie być widoczna lub w inny sposób widoczna na obrazie ultradźwiękowym. Ponadto plamki i cienie na obrazach ultradźwiękowych mogą utrudniać interpretację obrazów. Mówiąc inaczej, USG może w niektórych przypadkach nie dostarczać wystarczająco szczegółowych informacji o obrazie w celu identyfikacji tkanki lub regionów zainteresowania. Natomiast metody obrazowania metodą rezonansu magnetycznego (MRI) mogą ujawniać tkanki lub nowotwory, które są izoechogeniczne w TRUS, a zatem nie do odróżnienia od normalnej tkanki w obrazowaniu ultrasonograficznym. Ponieważ MRI jest techniką obrazowania medycznego stosowaną w radiologii do wizualizacji szczegółowych struktur wewnętrznych to dobry kontrast między różnymi tkankami miękkimi organizmu czyni go szczególnie przydatnym w porównaniu z innymi technikami obrazowania medycznego, takimi jak tomografia komputerowa (CT), promieniowanie rentgenowskie lub ultradźwięki. MRI wykorzystuje potężne pole magnetyczne do wyrównania namagnesowania niektórych atomów w ciele, a następnie wykorzystuje pola częstotliwości radiowej do systematycznej zmiany wyrównania tego namagnesowania. Informacje te są rejestrowane w celu utworzenia obrazu zeskanowanego obszaru ciała. Czasy skanowania skanerów MRI mogą się różnić, ale zwykle uzyskanie co najmniej kilku minut na uzyskanie obrazu, a niektóre starsze modele mogą wymagać do 40 minut na całą procedurę. W związku z tym stosowanie takich skanerów MRI do prowadzenia w czasie rzeczywistym jest ograniczone. Skanery MRI zazwyczaj generują wiele dwuwymiarowych przekrojów (plasterków) tkanki, a te plastry są układane w stosy w celu wytworzenia trójwymiarowych rekonstrukcji. Oznacza to, że program może budować wolumin przez „układanie” pojedynczych plasterków jeden na drugim. W związku z tym MRI może generować obrazy przekrojowe w dowolnej płaszczyźnie (w tym płaszczyzny ukośne). Podczas gdy uzyskana rozdzielczość w płaszczyźnie może być wysoka, to te obrazy przekrojowe często mają zmniejszoną klarowność ze względu na grubość plastrów. Na przykład lewy panel na FIG. 4 ilustruje normalny widok w płaszczyźnie obrazu MRI. Jak widać, obraz ten zapewnia dobrą rozdzielczość interesujących struktur w obrazie. Natomiast lewy panel z FIG.5 ilustruje płaszczyznę skośną, która rozciąga się przez wiele ułożonych w stos płaszczyzn MRI. Jak pokazano, struktury w tych skośnych widokach są trudne do rozróżnienia ze względu na grube płaskie płaszczyzny MRI. Inaczej mówiąc, większość obrazów MRI nie daje danych, które można odtworzyć w dowolnej płaszczyźnie bez utraty jakości obrazu. Zazwyczaj obraz 3D MRI jest podzielony na pewną liczbę wycinków, a granica gruczołu jest obliczana indywidualnie dla każdego wycinka. Oznacza to, że każdy wycinek jest indywidualnie segmentowany, równolegle lub kolejno. W niektórych przypadkach granice w jednym plasterku mogą być propagowane przez sąsiadujące plasterki, aby zapewnić początkową inicjalizację sąsiednich plasterków. Gdy wszystkie plasterki zostaną podzielone na segmenty, objętość zainteresowania, patrząc z boku, może mieć wygląd stopni schodkowych. Aby zapewnić gładki model powierzchniowy, system zawiera regulację wygładzającą w ramach segmentacji lub może zastosować filtr wygładzający po segmentacji z wykorzystaniem różnych algorytmów dotyczących wielkości prostaty. Oznacza to, że system może wykorzystywać zapisane granice do generowania modelu powierzchni 3D i objętości dla prostaty obrazu MRI. Pomimo zalet stosowania MRI do identyfikacji {regions of interest }ROI w obrębie gruczołu krokowego, ultradźwięki i TRUS w szczególności pozostają bardziej praktyczną metodą wykonywania biopsji lub procedury leczenia ze względu na koszty, złożoność i ograniczenia czasowe związane z bezpośrednimi procedurami pod kontrolą MRI. Tak więc uznano, że byłoby pożądane nakładanie lub integrowanie informacji uzyskanych z wcześniej uzyskanego obrazu MRI z obrazem TRUS w czasie rzeczywistym, aby pomóc w wyborze miejsc do biopsji lub leczenia, jak również do prowadzenia instrumentów podczas takich procedur. W takim układzie obrazy MRI i TRUS mogą być rejestrowane, a dwie zarejestrowane wielkości mogą być wizualizowane jednocześnie, np. obok siebie.
Ponieważ oba obrazy uzyskuje się w różnym czasie, może wystąpić zmiana kształtu gruczołu krokowego związana z jego wzrostem lub kurczeniem się, ruchem lub pozycją pacjenta, deformacją gruczołu krokowego spowodowaną przez sondę TRUS, perystaltyką, zawartością brzucha itp. Ponadto obrazy można uzyskać z różnych perspektyw w stosunku do pacjenta. Odpowiednio, użycie takiego wcześniej uzyskanego obrazu MRI z bieżącym obrazem TRUS będzie wymagało rejestracji obrazów. Na przykład, treść obrazów może wymagać sztywnego obracania, aby dopasować je do obrazów we wspólnej ramce odniesienia. Ponadto, gdy obrazy są sztywno wyrównane, jeden z obrazów może wymagać elastycznego odkształcenia, aby dopasować się do drugiego obrazu. FIG.6(A-D) ilustrują potrzebę zarejestrowania dwóch obrazów pojedynczej prostaty, które uzyskano przy użyciu różnych sposobów obrazowania, badając różnice kształtu między ich odpowiednimi modelami powierzchni. Rejestracja służy do znalezienia deformacji między podobnymi obiektami anatomicznymi, tak że między rejestrowanymi obrazami ustalana jest korespondencja punkt-punkt. Korespondencja oznacza, że pozycja podobnych tkanek lub struktur jest znana na obu obrazach. FIG.6A i 6B ilustrują pierwszy i drugi model powierzchni 240 i 250, np., które mogą być renderowane na ekranie USG lekarza. Termin fuzja jest czasami używany do zdefiniowania procesu rejestrowania dwóch obrazów, które są uzyskiwane za pomocą różnych metod obrazowania. Jak wspomniano powyżej, różne sposoby obrazowania mogą zapewniać różne korzyści. Na przykład USG zapewnia ekonomiczny system obrazowania w czasie rzeczywistym, podczas gdy MRI może dostarczyć szczegółowych informacji o tkance, których nie można zaobserwować na USG. Jednak rejestracja / połączenie tych różnych sposobów wizualizacji stwarza kilka wyzwań. Jest to szczególnie prawdziwe w zastosowaniach tkanek miękkich, takich jak obrazowanie prostaty, gdzie kształt obiektu na dwóch obrazach może się zmieniać między akwizycją każdego obrazu. Ponadto, w przypadku obrazowania prostaty, ramy odniesienia (FOR- Frame of reference) uzyskanych obrazów są zazwyczaj różne. Oznacza to, że obrazy gruczołu krokowego MRI można zazwyczaj z grubsza dopasować do pozycji pacjenta (od stóp do głów, od przodu do tyłu i od lewej do prawej). Natomiast obrazy TRUS są często nabywane, gdy pacjent leży na boku w pozycji płodowej. Akwizycja obrazu zależy od kąta wstawienia sondy, wprowadzając jej własne lokalne odniesienie (FOR). Jedynym znanym powiązaniem między obrazami prostaty z różnych modalności jest granica /powierzchnia prostaty. Oznacza to, że prostata jest obiektem elastycznym, ale ma granicę lub powierzchnię gruczołu, która określa objętość gruczołu krokowego. W związku z tym każdy punkt w obrębie objętości określonej przez granicę gruczołu w jednym obrazie powinien odpowiadać punktowi w obrębie objętości określonej przez granicę gruczołu na drugim obrazie. W związku z tym ustalono, że rejestracja modelu powierzchni jednego z obrazów na drugim obrazie może zapewnić początkowe odkształcenie, które może być następnie zastosowane do pola objętości 3D, które ma być zdeformowane. Oznacza to, że na początku procedury TRUS objętość 3D TRUS jest uzyskiwana z sondy ultradźwiękowej. Na przykład, jak pokazano na FIG.3, obszar zainteresowania 212 jest zilustrowany jako okrąg w normalnym widoku obrazu MRI 240. Taki obszar zainteresowania może rozciągać się przez szereg sąsiadujących płaszczyzn obrazu MRI i podobnie jak powierzchnia prostaty, może być wygładzony, aby wytworzyć granicę interesującego regionu 3D, co najlepiej ilustruje sferyczny obszar zainteresowania 212 w modelu powierzchniowym TRUS zilustrowanym w panelu 208 na FIG.3. Inaczej mówiąc, jeden lub więcej interesujących punktów lub regionów może być predefiniowanych we wcześniej uzyskanym obrazie MRI.
Po zarejestrowaniu obrazów MRI i TRUS w ramce odniesienia MRI, obrazy te mogą być mieszane w celu utworzenia obrazu złożonego, w którym informacje z obu obrazów są łączone i wyświetlane. To zilustrowano na FIG.7, gdzie w środkowym panelu, obraz 280 stanowi 50% połączenie każdego obrazu MRI i obrazu TRUS. Oznacza to, że każdy piksel w wynikowym obrazie może być 50% mieszanką odpowiedniego piksela i obrazu MRI oraz obrazu TRUS. Aby poprawić zdolność użytkowników do wybierania punktów zainteresowania w zarejestrowanych obrazach, niniejsza aplikacja umożliwia ponadto dostosowanie kombinacji lub mieszanki obrazów przez użytkownika. W związku z tym użytkownik może dostosować mieszankę między 100% jednej objętości (np. Objętość MRI) a 100% drugiej objętości (np. Objętość TRUS). Jak pokazano, lewy panel 282 ilustruje obraz 100% MRI, a prawy panel 284 ilustruje obraz w 100% TRUS. W związku z tym użytkownik może poruszać się pomiędzy obrazami przedstawionymi we wspólnej ramce odwołań pojedynczego obrazu, aby zobaczyć, czy istnieje zgodność między obiektem z obrazu MRI a obrazu TRUS. FIG.8 ilustruje cały system 300, który zapewnia wielomodalną fuzję obrazu, która może być stosowana w aplikacji do biopsji i / lub TFT. Jak pokazano, region po lewej stronie linii przerywanej ilustruje przetwarzanie, które można wykonać w trybie offline przed biopsją lub TFT. Początkowo uzyskuje się obraz MRI 310, który podlega segmentacji 312, aby uzyskać kształt lub powierzchnię modelu 314, który w mogą być przedstawione w postaci trójkątnej siatki wzdłuż granicy prostata. Przykład wykonania takiej granicy siatki 360 przedstawiono na FIG.9. FIG.10 przedstawia bardziej szczegółowy widok segmentacji wykonanej zarówno na obrazie MRI, jak i na obrazie 3D TRUS. Procedura segmentowania tych powierzchni jest podobna, a poniższe omówienie dotyczy segmentacji zarówno obrazu MRI, jak i obrazu TRUS, chociaż omówiono je przede wszystkim w odniesieniu do obrazu TRUS. FIG.11 ilustruje proces rejestracji. W tej realizacji obie objętości 310, 312 są dostarczone jako dane wejściowe, z ich odpowiednimi kształtami powierzchni 314, 324 (np.trójkątne kształty siatki). W szczególności, treść zobrazowań jest przetwarzana przez procesor zbieżności 440, który zapewnia, że początkowe sztywne wyrównanie jest stosowane do jednego z woluminów opartych na heurystyce oprócz korespondencji określonej przez użytkownika. Oznacza to, że początkowa sztywna transformacja jest stosowana do jednego z dwóch woluminów opartych na heurystykach, takich jak wartości kodera trackera, które lokalizują położenie anatomii na obrazach w przestrzeni 3D dla zobrazowania ultradźwiękowego 320. FIG.12,13 ilustruje deformację powierzchni pomiędzy obrazami 3D TRUS oraz MRI.
Ponieważ nie ma róży bez kolca każda biopsja niesie ryzyko zapalenia gruczołu krokowego w związku z tym przed każda biopsja bierze się osłonowo antybiotyk , który ma zapobiec infekcji spowodowanej nakłuwaniem osobistego gruczołu prostaty, który tak zasłużona role odgrywa w naszym codziennym życiu, że nie wspomnę o prokreacji.
Patent PL232535 Igła do biopsji stercza, Marcin Sieczkowski, Gibas Artur, Data patentu 28.06.2019 przedstawia sposób udoskonalenia podstawowej metodyki diagnostyki raka stercza, który stosuje nowatorskie igły do biopsji stercza, metodą przez odbytniczą pod kontrolą USG. 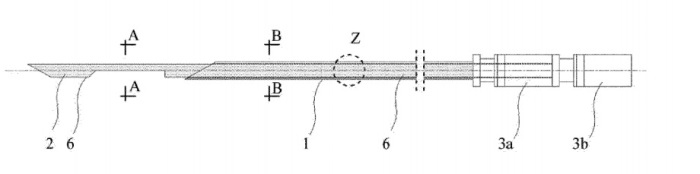
Igła biopsyjna, według wynalazku, umożliwia bezpośrednie podanie albo uwolnienie z powierzchni igły bezpośrednio do stercza antybiotyków, leków przeciwzapalnych oraz innych substancji o działaniu biologicznie aktywnym. Zastosowane środki biologicznie aktywne uwalniane lub podawane są jednoczasowo w trakcie wykonywania biopsji i nie wymaga to dodatkowych nakłuć stercza. Korzystnym skutkiem wykorzystania wynalazku jest fakt, że środki biologicznie aktywne wprowadzane są poprzez igłę precyzyjnie w miejsce będące potencjalnym punktem wyjścia infekcji. Pozwala to na ograniczenie lub całkowite wyeliminowanie doustnej czy dożylnej profilaktyki antybakteryjnej. Ponadto efektywna ilość leków podawanych bezpośrednio do stercza może być znacząco mniejsza niż ma to miejsce w przypadku leków aplikowanych ogólnie. Wynalazek umożliwia również jednoczasowe zastosowanie miejscowe zestawu antybiotyków, co pozwala na poszerzenie spektrum ochrony przeciwbakteryjnej przy jednoczesnym niewielkim ryzyku wystąpienia działań niepożądanych. Wynalazek umożliwia wprowadzenie nowej formy około-zabiegowej profilaktyki zakażeń w trakcie biopsji stercza. Wynalazek umożliwia również jednoczesne podawanie kilku środków o działaniu biologicznie aktywnym w tym kilku substancji leczniczych – leków znieczulających i/lub przeciwzapalnych i/lub przeciwbakteryjnych i/lub zwiększających krzepliwość krwi.
Wynalazek pokazany jest bliżej w przykładach wykonania i na rysunkach, na których na fig. 1 pokazano igłę biopsyjną w widoku z góry, na fig. 2 igłę biopsyjną w widoku z boku, na fig. 3 przekrój poprzeczny przez mandryn wzdłuż linii A-A z fig. 1, na fig. 4 przekrój poprzeczny przez mandryn i kaniulę wzdłuż linii B-B z fig. 1, na fig. 5 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu Z z fig.1 i fig.2; na fig.6 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 7 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu Y z fig. 6; na fig.8 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 9 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu X z fig. 8; na fig. 10 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 11 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu W z fig. 10; na fig.12 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 13 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu V z fig. 13; na fig. 14 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 15 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu U z fig. 14; na fig. 16 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 17 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu T z fig. 16; na fig. 18 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 19 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu S z fig. 18, na fig. 20 powiększenie powierzchni kaniuli; na fig. 21 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 22 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu R z fig. 21, na fig. 23 powiększony widok aksonometryczny z rozwiniętymi układami warstw wycinka igły biopsyjnej I z fig. 21; na fig. 24 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 25 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu Q z fig. 24, na fig. 26 powiększony widok aksonometryczny z rozwiniętymi układami warstw wycinka igły biopsyjnej II z fig. 24; na fig. 27 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 28 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu P z fig. 27; na fig. 29 igłę biopsyjną w widoku z boku, w kolejnym wariancie wykonania, na fig. 30 powiększenie przekroju podłużnego przez mandryn i kaniulę w miejscu O z fig. 29, na fig. 31 powiększony widok aksonometryczny z rozwiniętymi układami warstw wycinka igły biopsyjnej III z fig. 29, na fig. 32 schemat anatomiczny okolicy stercza w trakcie wykonywania biopsji. Stalowa igła biopsyjna, o długości 200 mm, składa się z ostro zakończonej kaniuli 1, osadzonego przesuwnie w kaniuli 1 ostro zakończonego mandrynu 2 oraz w tylnej części zaopatrzona jest w wykonane z polipropylenu uchwyty do pistoletu biopsyjnego – uchwyt w kaniuli 3a i uchwyt w mandrynie 3b. Średnica zewnętrzna kaniuli 1 wynosi 1,93 mm, średnica wewnętrzna kaniuli 1 wynosi 1,70 mm, a średnica mandrynu 2 wynosi 1,65 mm. Wewnętrzna powierzchnia 4 kaniuli 1 i zewnętrzna powierzchnia 5 kaniuli 1 oraz powierzchnia mandrynu 2, na całej długości stalowej igły, pokryte są warstwą aktywną 6 zawierającą środek biologicznie aktywny, co pokazano na fig. 1, 2, 3, 4, 5. Warstwa aktywna 6 umożliwia kontrolowane uwalnianie środka biologicznie aktywnego. Warstwa aktywna zawiera dwa antybiotyki – ciprofloksacynę oraz amikacynę, które tworzą kompleks inkluzyjny z b-cyklodekstryną. Warstwę aktywną 6 uzyskano w ten sposób, że powierzchnię igły pokryto mieszaniną uzyskaną poprzez wymieszanie w wirówce (5 min i 30 rpm) ciprofloksacyny, amikacyny i b-cyklodekstryny w proporcjach molalnych 1:1:2. Mieszaninę związków rozpuszczono w 0,14% wodnym roztworze wodorku azotu (III). Uzyskany roztwór przefiltrowano. Po zanurzeniu stalowych elementów kaniuli 1 i mandrynu 2 w roztworze, przeprowadzono proces liofilizacji uzyskując utrwalenie warstwy aktywnej 6. Utworzona warstwa aktywna 6 ma formę biodegradowalną i ulega rozpuszczeniu pod wpływem temperatury ciała oraz wody zawartej w krwi i tkance bioptowanej. Jak pokazano na fig. 32 przy użyciu pistoletu biopsyjnego oraz igły biopsyjnej, pod kontrolą ultrasonografii transrektalnej, pobierano w sposób typowy oligobiopty stercza s. W trakcie zabiegu, pod wpływem temperatury ciała i wody, warstwa aktywna 6 stopniowo uwalniała ciprofloksacynę i amikacynę bezpośrednio do tkanki stercza na drodze rozpadu kompleksu inkluzyjnego b-cyklodekstryny z antybiotykami. Badania in vitro i in vivo, potwierdziły uwalnianie się leków z warstwy aktywnej 6 naniesionej na stalową powierzchnię igły biopsyjnej oraz skuteczny efekt antybakteryjny w obszarze o działania środka biologicznie aktywnego.
WNIOSKI
Biopsja fuzyjna prostaty przeznaczona jest do wykonywania u mężczyzn z podejrzeniem raka gruczołu krokowego (nowotwór prostaty) w celu potwierdzenia lub odrzucenia podejrzenia obecności komórek nowotworowych. Zabieg można wykonać u osobników płci męskiej, którzy mają podwyższony poziom stężenia PSA lub inne nieprawidłowe wyniki badań. Warto pamiętać, że nie każdy mężczyzna z podwyższonym PSA kierowany jest do badania jakim jest biopsja fuzyjna prostaty. Wysoki poziom stężenia PSA w krwi może być także objawem przerostu lub stanu zapalnego prostaty. Dlatego należy pamiętać, że diagnostyka w kierunku raka prostaty powinna być zawsze prowadzona pod kontrolą i opieką doświadczonego lekarza specjalisty urologa. Ponieważ biopsja fuzyjna w niektórych przypadkach może być procedurą dość inwazyjną, warto pamiętać o nowoczesnych narzędziach diagnostycznych, takich jak na przykład płynna biopsja prostaty. Badanie SelectMDx płynna biopsja prostaty to badanie na podstawie próbki moczu, które ocenia procentowe ryzyko wykrycia agresywnego – czyli istotnego klinicznie nowotworu stercza (rak prostaty) podczas biopsji, co pozwala na podjęcie decyzji o konieczności jej wykonania. Przedstawione opisy patentowe przedstawiają nowatorskie rozwiązania z zakresu procedur medycznych dotyczących sposobu i systemu do ultrasonograficznej biopsji prostaty z wykorzystaniem biomechanicznego modelu gruczołu krokowego z danych obrazowania rezonansu magnetycznego (MR). Przykłady wykonania niniejszego wynalazku wykorzystują obrazowanie MR do lokalizowania guzów i strefy obwodowej prostaty i wykorzystują te informacje podczas biopsji stercza sterowanej ultradźwiękami w celu dokładnego kierowania igły do miejsc ze zmianami ogniskowymi. Przykłady wykonania niniejszego wynalazku zapewniają zautomatyzowany proces, który jest ważny dla wdrożenia klinicznego. Przykłady wykonania niniejszego wynalazku mapują uszkodzenia zlokalizowane w danych obrazu MR na akwizycję USG podczas skanowania gruczołu podczas biopsji, a także zapewniają aktualizacje w czasie rzeczywistym wyprowadzonych lokalizacji zmian chorobowych z powodu zmiany w płaszczyźnie skanowania USG i późniejsze deformacje gruczołu krokowego spowodowane przez USG. Nowość metody badawczej dotyczy wiec sposobu i systemu do ultrasonograficznej (US) biopsji igły stercza opartej na biomechanicznym modelu prostaty z danych obrazowania rezonansu magnetycznego (MR), który zapewnia zwiększoną skuteczność na procedury biopsji prostaty w celu wykrycia raka prostaty. Zazwyczaj identyfikacja biopsji gruczołu krokowego przeprowadzana jest systematycznie zgodnie ze wskazówkami USG, które mogą nie mieć czułości w wykrywaniu zmian złośliwych. W celu zwiększenia czułości biopsji gruczołu krokowego możliwe jest wykorzystanie podejrzanych informacji o lokalizacji uszkodzenia z wysokiej jakości skanowania 3D, takiego jak objętość MR, podczas procedury biopsji prostaty. Informacje o lokalizacji uszkodzeń pomagają w optymalnym umieszczeniu rdzenia igły w celu pobrania wystarczających i dokładnych próbek patologicznych, a tym samym zwiększenia czułości wykrywania tkanki rakowej. Przykłady wykonania niniejszego wynalazku łączą dane obrazu MR pacjenta z obrazami US w czasie rzeczywistym uzyskanymi podczas skanowania biopsji, aby zapewnić lepsze ukierunkowanie na podejrzenie guza lub zmian w gruczole krokowym. Ponadto, przykład wykonania niniejszego wynalazku przewidują deformację gruczołu krokowego zachodzącą w czasie rzeczywistym w wyniku zmiany lokalizacji i orientacji sondy USG i wykorzystania przewidywanej deformacji gruczołu krokowego do aktualizacji informacji o lokalizacji tkanki rakowej na podstawie mapowania MR oraz rzeczywistym zobrazowaniu USG prostaty.
Jak aktualną sprawą jest biopsja-fuzyjna-prostaty może świadczyć oferta reklamowa znanej firmy VOXEL SA. https://www.voxel.pl/biopsja-fuzyjna-prostaty, która jako pierwsza w Polsce oferuje tego typu badania w Medycznych Centrach Diagnostycznych w Warszawie, tzn. w jednym ośrodku łączy zobrazowanie MR z badaniem histopatologicznym na podstawie fuzji obrazów MR/USG.